
科目: 來源:不詳 題型:計算題
| 實驗 | 1 | 2 | 3 | 4 | 5 |
| 樣品質量/g | 13 | 13 | 13 | 13 | 13 |
| 加入鹽酸質量/g | 15 | 30 | 80 | 130 | 150 |
| 反應后物質質量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |

查看答案和解析>>
科目: 來源:不詳 題型:填空題

 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O| 反應前 | 反應后 |
| E的質量為100.0g | E的質量為102.25g |
| F的質量為50.0g | F的質量為51.1g |
查看答案和解析>>
科目: 來源:不詳 題型:計算題
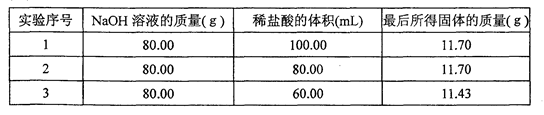
查看答案和解析>>
科目: 來源:不詳 題型:計算題
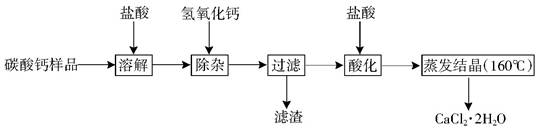
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | |
| 開始沉淀時的pH | 2.3 | 4.0 | 開始溶解:7.8 |
| 完全沉淀時的pH | 3.7 | 5.2 | 完全溶解:10.8 |
查看答案和解析>>
科目: 來源:不詳 題型:計算題

查看答案和解析>>
科目: 來源:不詳 題型:計算題
| 溫度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |



查看答案和解析>>
科目: 來源:不詳 題型:計算題
查看答案和解析>>
科目: 來源:不詳 題型:計算題

查看答案和解析>>
科目: 來源:不詳 題型:計算題
| 蒸發(fā)皿的質量(g) | 25.0 |
| 蒸發(fā)皿+食鹽溶液(g) | 45.0 |
| 蒸發(fā)皿+食鹽晶體(g) | 27.4 |
| 數(shù)據(jù)處理 | 溶液的溶質質量分數(shù)為 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com