
科目: 來源:不詳 題型:填空題
| | | | | ① | ② | |
| ③ | | ④ | ⑤ | | ⑥ | ⑦ |
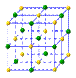
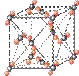
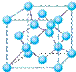
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.原子半徑 B>A>C>D | B.最高價氧化物水化物的堿性B>A |
| C.離子半徑 C3—>D—>B+>A2+ | D.氫化物的穩(wěn)定性 C >D |
查看答案和解析>>
科目: 來源:不詳 題型:填空題

查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.35Cl原子所含質(zhì)子數(shù)為18 |
| B.1/18mol的1H35Cl分子所含中子數(shù)約為6.02×1023 |
| C.35g35Cl2氣體的體積約為11.2L |
| D.35Cl2氣體的摩爾質(zhì)量為71g.mol-1 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.該元素的原子序數(shù)是72 | B.該元素的原子序數(shù)是185 |
| C.該原子相對原子質(zhì)量是185 | D.該元素是一種新元素 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
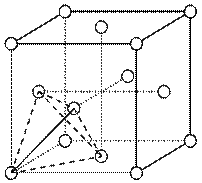
查看答案和解析>>
科目: 來源:不詳 題型:填空題
查看答案和解析>>
科目: 來源:不詳 題型:填空題
| A.XY2Z3 | B.X2YZ4 | C.X3YZ4 | D.X3YZ3 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
| A.原子半徑:Li<Na<K | B.酸性: H2SiO3 < H2CO3 < HNO3 < HClO4 |
| C.穩(wěn)定性: SiH4 > H2S> HF | D.堿性: NaOH > Mg(OH)2 > Be (OH)2 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
| A.砹是有色固體 | B.HAt很穩(wěn)定 |
| C.砹較易溶于有機溶劑 | D.AgAt不溶于水 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com