相關(guān)習(xí)題
0 11793 11801 11807 11811 11817 11819 11823 11829 11831 11837 11843 11847 11849 11853 11859 11861 11867 11871 11873 11877 11879 11883 11885 11887 11888 11889 11891 11892 11893 11895 11897 11901 11903 11907 11909 11913 11919 11921 11927 11931 11933 11937 11943 11949 11951 11957 11961 11963 11969 11973 11979 11987 203614
科目:
來(lái)源:北京期中題
題型:推斷題
W�����、X、Y����、Z是原子序數(shù)依次增大的短周期元素���。W的最外層電子數(shù)是電子層數(shù)的2倍。Y是金屬�����,可以和X形成1︰1和2︰1兩種化合物�。Z的最高正價(jià)與最低負(fù)價(jià)的代數(shù)和為4����。
(1)寫出WX2的電子式___________________。
(2)用元素符號(hào)表示X���、Y�、Z原子半徑由大到小的順序_____>_____>_____����。
(3)含1 mol Z的最高價(jià)氧化物對(duì)應(yīng)水化物的稀溶液與足量Y的最高價(jià)氧化物對(duì)應(yīng)水化物的稀溶液反應(yīng)放出熱量114.6 kJ,寫出此反應(yīng)的熱化學(xué)方程式:___________________����。
(4)在一定量Y的最高價(jià)氧化物對(duì)應(yīng)水化物的稀溶液中通入過(guò)量WX2,用離子濃度表示該溶液中的電荷守恒____________________��。
(5)Y2ZX4與WX、H2在高溫和鐵做催化劑條件下反應(yīng)�����,0.1 mol Y2ZX4參加反應(yīng)轉(zhuǎn)移0.8 mol電子��,消耗標(biāo)況下H2的體積為4.48 L���,該反應(yīng)的化學(xué)方程式為_______________________��。
查看答案和解析>>
科目:
來(lái)源:北京期中題
題型:單選題
100 mL 0.1 mol/L的鹽酸與50 mL 0.2 mol/L的氨水混合�,充分反應(yīng)后�,所得溶液中各種離子濃度關(guān)系正確的是
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(H+)+c(NH4+)=c(Cl-) +c(OH-)
D.c(H+)+c(Cl-)=c(NH4+)+c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:
來(lái)源:0115 競(jìng)賽題
題型:填空題
(1)在25℃條件下將pH=11的氨水稀釋100倍后溶液的pH為______________(填序號(hào))。
A.9 B.13 C.11~13之間 D.9~11之間
(2)25℃時(shí)���,向0.1mol/L的氨水中加入少量氯化銨固體���,當(dāng)固體溶解后,測(cè)得溶液pH減小����,主要原因是(填序號(hào))______________。
A.氨水與氯化銨發(fā)生化學(xué)反應(yīng)
B.氯化銨溶液水解顯酸性���,增加了c(H+)
C.氯化銨溶于水�,電離出大量銨離子,抑制了氨水的電離�,使c(OH-)減小
(3)室溫下,如果將0.1mol NH4Cl和0.05mol NaOH全部溶于水���,形成混合溶液(假設(shè)無(wú)損失)����,
①_________和__________兩種粒子的物質(zhì)的量之和等于0.1mol��。
②_________和__________兩種粒子的物質(zhì)的量之和比OH-多0.05mol���。
(4)已知某溶液中只存在OH-、H+�、NH4+、Cl-四種離子�,某同學(xué)推測(cè)該溶液中各離子濃度大小順序可能有如下四種關(guān)系
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
① 若溶液中只溶解了一種溶質(zhì),該溶質(zhì)的名稱是____________����,上述離子濃度大小順序關(guān)系中正確的是
______________(選填序號(hào)) 。
② 若上述關(guān)系中C是正確的��,則溶液中溶質(zhì)的化學(xué)式是______________。
③ 若該溶液中由體積相等的稀鹽酸和氨水混合而成����,且恰好呈中性,則混合前c(HCl)__________(填“>”�、“<”、或“=”�����,下同) c(NH3·H2O)��,混合后溶液中c(NH4+)與c(Cl-)的關(guān)系c(NH4+)
___________ c(Cl-)��。
查看答案和解析>>
科目:
來(lái)源:0110 期中題
題型:不定項(xiàng)選擇題
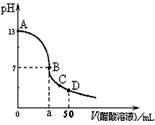
在25mL0.1mol·L-1 NaOH溶液中逐滴加入0.1mol·L-1 CH3COOH溶液����,曲線如圖所示,有關(guān)粒子濃度關(guān)系正確的是
A.在A�、B間任一點(diǎn),溶液中一定都有:c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B點(diǎn)����,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C點(diǎn):c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D點(diǎn):c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:
來(lái)源:專項(xiàng)題
題型:不定項(xiàng)選擇題
25℃時(shí),下列溶液中微粒的物質(zhì)的量濃度關(guān)系正確的是
A.pH=7的NaHSO3與Na2SO3混合溶液中:3c(Na+) =c(HSO3-)+c(SO32-)
B.0.1 mol·L-1的KHA溶液�,其pH=10:c(K+)>c(HA-)>c( OH-)> c(H+)
C.20 mL 0.1 mol·L-1醋酸鈉溶液與10 mL 0.1 mol·L-1鹽酸混合后的溶液中:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
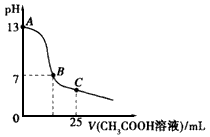
D.在25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1 CH3COOH溶液,溶液pH變化如上圖所示����,在A、B間任一點(diǎn)��,溶液中一定都存在下列關(guān)系: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:
來(lái)源:專項(xiàng)題
題型:不定項(xiàng)選擇題
對(duì)下列各溶液中���,微粒的物質(zhì)的量濃度關(guān)系表述正確的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42- )>c(NH4+)>c(H+)>c(OH-)
B.0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+ 2c(CO32- )
C.將0.2 mol·L-1 NaA溶液和0.1mol·L-1鹽酸等體積混合所得堿性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃100 mL NH4 Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:
來(lái)源:專項(xiàng)題
題型:不定項(xiàng)選擇題
0.02mol·L-1的HCN溶液與0.02mol·L-1的NaCN溶液等體積混合��,已知混合溶液中c(CN-)<c(Na+)���,則下列關(guān)系中,正確的是
A�����、c(Na+)>c(CN-)>c(OH-)>c(H+)
B����、c(HCN)+c(CN-)=0.04mol·L-1
C���、c(Na+)=c(CN-)+c(OH-)
D�、c(CN-)>c(HCN)
查看答案和解析>>
科目:
來(lái)源:專項(xiàng)題
題型:推斷題
A、B���、C�����、D均為4種常見的短周期元素��,原子序數(shù)依次增大��,A�、C能組成分子式為A2C2和A2C兩種常見的化合物�,它們?cè)诔叵露?是液體;B與A既可形成分子X�,也可形成陽(yáng)離子Y,X�����、Y都是10電子的粒子����;D 在同周期中原子半徑最大��。
(1)D元素在周期表中的位置是____��;D的單質(zhì)在C的單質(zhì)中燃燒生成固體W的電子式為____�����; 液態(tài)X類似A2C����,也能微弱電離且產(chǎn)生電子數(shù)相同的兩種離子�,則液態(tài)X電離方程式為____。
(2)將C的單質(zhì)通入1 mol/L KI和0.1 mol/L H2SO4混合溶液中�,反應(yīng)的離子方程式為____。
(3)M���、N分別是由A�����、B、C��、D四種元素中的其中三種元素組成的強(qiáng)電解質(zhì)�。M 的水溶液呈堿性,它能抑制水的電離;N的水溶液呈酸性����,它能促進(jìn)水的電離。則M��、N分別為___��、____(填化學(xué)式)���;若將0.1 mol/L的M 和0.2 mol/L的N兩溶液等體積混合���,所得溶液中離子濃度的大小順序?yàn)開___。
查看答案和解析>>
科目:
來(lái)源:專項(xiàng)題
題型:填空題
(1)大氣中SO2含量過(guò)高會(huì)導(dǎo)致雨水中含有(填化學(xué)式)__________而危害植物和建筑物�。工廠排放的SO2尾氣用飽和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反應(yīng)的化學(xué)方程式為____________����。
(2)已知NaHSO3的水溶液顯酸性,比較其中SO32- ��、HSO3-��、H2SO3三種粒子的濃度�����,最大的是_________,最小的是_____________�����。
(3)SO2是空氣質(zhì)量報(bào)告的指標(biāo)之一��,可用SO2還原KIO3生成I2的反應(yīng)測(cè)定空氣中SO2含量�。每生成0.01mol I2,參加反應(yīng)的SO2為__________mol���。
(4)已知25℃時(shí)��,Ksp(BaSO4)=1.1×10-10�,Ksp(BaCO3)=2.6×10-9�����。下列說(shuō)法不正確的是__________�。
A.25℃時(shí),向BaSO4懸濁液中加入大量水��,Ksp(BaSO4)不變
B.25℃時(shí)��,向BaSO4懸濁液中加入Na2CO3溶液后���,BaSO4不可能轉(zhuǎn)化為BaCO3
C.向Na2SO4溶液中加入過(guò)量BaCl2溶液后�,溶液中c(SO42- )降低為零
查看答案和解析>>
科目:
來(lái)源:江西省月考題
題型:單選題
已知乙酸(HA)的酸性比甲酸(HB)弱�,在物質(zhì)的量濃度均為0.1 mol/L的NaA和NaB混合溶液中,下列排序正確的是
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>