相關(guān)習(xí)題
0 11942 11950 11956 11960 11966 11968 11972 11978 11980 11986 11992 11996 11998 12002 12008 12010 12016 12020 12022 12026 12028 12032 12034 12036 12037 12038 12040 12041 12042 12044 12046 12050 12052 12056 12058 12062 12068 12070 12076 12080 12082 12086 12092 12098 12100 12106 12110 12112 12118 12122 12128 12136 203614
科目:
來(lái)源:0110 期末題
題型:單選題
在溶液中有濃度均為0.01mol/L的Fe3+����、Cr3+�、Zn2+��、Mg2+等離子���,已知:Ksp[Fe(OH)3]=2.6×10-39�; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17���; Ksp[Mg(OH)2] =1.8×10-11當(dāng)氫氧化物開(kāi)始沉淀時(shí)�,下列哪一種離子所需溶液的pH最小
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
查看答案和解析>>
科目:
來(lái)源:0116 期中題
題型:單選題
已知CuSO4溶液分別與Na2CO3溶液����、Na2S溶液的反應(yīng)情況如下:
(1) CuSO4+Na2CO3 主要:Cu2++ CO32- + H2O = Cu(OH)2↓+ CO2↑ 次要:Cu2+ + CO32-= CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2- = CuS↓ 次要:Cu2+ + S2-+ 2H2O = Cu(OH)2↓+ H2S↑
則下列幾種物質(zhì)的溶解度大小的比較中,正確的是
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
向AgCl飽和溶液中加水��,下列敘述正確的是
A.AgCl的溶解度增大
B.AgCl的溶解度�����、Ksp均不變
C.AgCl的Ksp增大
D.AgCl的溶解度�����、Ksp均增大
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
在下列溶液中,BaSO4的溶解度最大的是
A.1 mol·L-1H2SO4溶液
B.2 mol·L-1H2SO4溶液
C.純水
D.0.1 mol·L-1H2SO4溶液
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
AgCl和Ag2CrO4的溶度積分別為1.8×10-10mol2·L-2和2.0×10-12mol3·L-3��,若用難溶鹽在溶液中的濃度來(lái)表示其溶解度���,則下面的敘述中正確的是
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.兩者類(lèi)型不同���,不能由Ksp的大小直接判斷溶解能力的大小
D.都是難溶鹽,溶解度無(wú)意義
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
下列說(shuō)法正確的是
A.在一定溫度下AgCl水溶液中�����,Ag+和Cl-濃度的乘積是一個(gè)常數(shù)
B.AgCl的Ksp=1.8×10-10mol2·L-2��,在任何含AgCl固體的溶液中�����,c(Ag+)=c(Cl-)且Ag+與Cl-濃度的乘積等于1.8×10-10mol2·L-2
C.溫度一定時(shí)���,當(dāng)溶液中Ag+和Cl-濃度的乘積等于Ksp值時(shí)�����,此溶液為AgCl的飽和溶液
D.向飽和AgCl水溶液中加入鹽酸��,Ksp值變大
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
下列敘述中���,正確的是
A.溶度積大的化合物溶解度肯定大
B.向含有AgCl固體的溶液中加入適量的水使溶解又達(dá)到平衡時(shí),AgCl的溶度積不變�,其溶解度也不變
C.將難溶電解質(zhì)放入水中,溶解達(dá)到平衡時(shí)�,電解質(zhì)離子的濃度的乘積就是該物質(zhì)的溶度積
D.AgCl水溶液的導(dǎo)電性很弱,所以AgCl為弱電解質(zhì)
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
已知常溫下:Ksp〔Mg(OH)2〕=1.2×10-11mol3·L-3 Ksp(AgCl)=1.8×10-10mol2·L-2 Ksp(Ag2CrO4)=
1.9×10-12 mol3·L-3�,Ksp(CH3COOAg)=2.3×10-3mol2·L-2下列敘述正確的是
A.等體積混合濃度均為0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定產(chǎn)生CH3COOAg沉淀
B.將0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先產(chǎn)生Ag2CrO4沉淀
C.在Mg2+為0.121 mol·L-1的溶液中要產(chǎn)生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向飽和AgCl水溶液中加入NaCl溶液�,Ksp(AgCl)變大
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
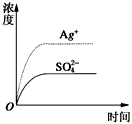
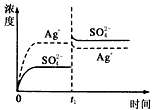
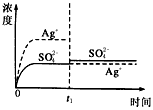
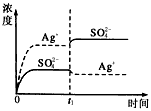
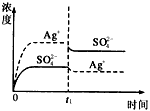
已知Ag2SO4的Kw為2.0×10-3,將適量Ag2SO4固體溶于100 mL水中至剛好飽和���,該過(guò)程中Ag+和SO42-濃度隨時(shí)間變化關(guān)系如圖〔飽和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1〕����。若t1時(shí)刻在上述體系中加入100 mL0.020 mol·L-1 Na2SO4溶液����,下列示意圖中,能正確表示t1時(shí)刻后Ag+和SO42-濃度隨時(shí)間變化關(guān)系的是
查看答案和解析>>
科目:
來(lái)源:同步題
題型:不定項(xiàng)選擇題
下列化學(xué)原理的應(yīng)用�����,主要是利用沉淀溶解平衡原理來(lái)解釋的是
①熱純堿溶液洗滌油污的能力強(qiáng);
②誤將鋇鹽[BaCl2�、Ba(NO3)2]當(dāng)做食鹽食用后,常用0.5%的Na2SO4溶液解毒���;
③溶洞����、珊瑚的形成���;
④碳酸鋇不能做“鋇餐”而硫酸鋇則能����;
⑤泡沫滅火器滅火的原理���。
A.②③④
B.①②③
C.③④⑤
D.全部
查看答案和解析>>