
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �����A�� | B�� | �x���I | C�� | ���r�I | D�� | �����I |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ��3�� | B�� | ��12�� | C�� | ��13�� | D�� | ��14�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �廯�yҊ��ֽ�׃�� | B�� | �����Uԇ������׃�� | ||
| C�� | ��������~���Ҵ�׃�t | D�� | �����ڿ՚���׃�ۼt |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CH2=CHCOOH | B�� | C15H31COOH | C�� | C17H33COOH | D�� | C17H35COOH |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
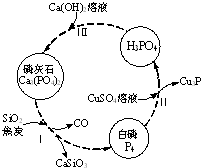 ��������Ҫ���������D(zhu��n)����D��ʾ��
��������Ҫ���������D(zhu��n)����D��ʾ��| �ɷ� | CaO | P2O5 | SO3 | CO2 |
| �|(zh��)���֔�(sh��)��%�� | 47.30 | 28.40 | 3.50 | 6.10 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
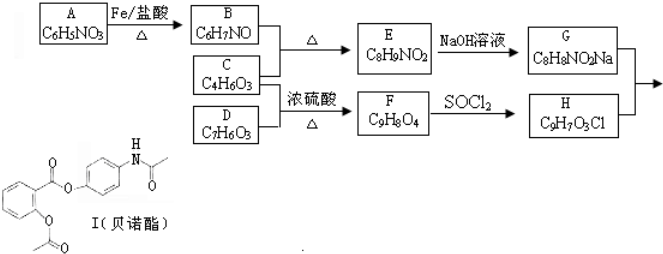
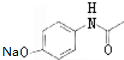 ��
��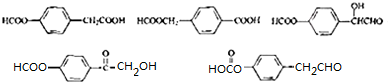 ��������N����
�����е����N����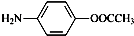 �ĺ�����·������ԇ�����x�������̈D��ʾ����������(y��ng)��a(ch��n)�P��Ҫ����(y��ng)�l������ʾ����CH4$��_{����}^{2Cl}$CH3Cl$��_{��}^{NaOH��Һ}$CH3OH��
�ĺ�����·������ԇ�����x�������̈D��ʾ����������(y��ng)��a(ch��n)�P��Ҫ����(y��ng)�l������ʾ����CH4$��_{����}^{2Cl}$CH3Cl$��_{��}^{NaOH��Һ}$CH3OH���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
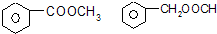 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
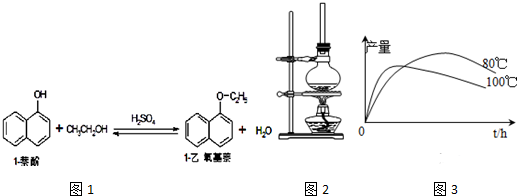
| ���|(zh��) | ������ ���|(zh��)�� | ��B(t��i) | ���c���棩 | ���c���棩 | �ܽ�� | |
| ˮ | �Ҵ� | |||||
| 1-���� | 144 | �oɫ���Sɫ���νY(ji��)�����ĩ | 96�� | 278�� | ����ˮ | �������Ҵ� |
| 1-�������� | 172 | �oɫҺ�w | 5.5�� | 267�� | ������ˮ | �������Ҵ� |
| �Ҵ� | 46 | �oɫҺ�w | -114.1�� | 78.5�� | ����Ȼ��� | |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
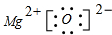 ��
��| I1 | I2 | I3 | I4 | �� | |
| ��x�ܣ�kJ/mol�� | 738 | 1451 | 7733 | 10540 | �� |
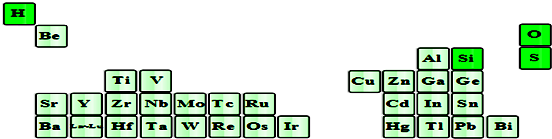
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com