
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

| ���|(zh��) | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| ���c(di��n)/�� | 57.6 | 180�����A�� | 300�����A�� | 1023 | 801 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
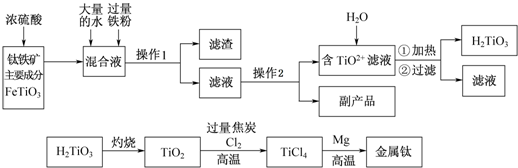
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

| �b�� | ��(sh��)�(y��n)ǰ���|(zh��)��/g | ��(sh��)�(y��n)����|(zh��)��/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
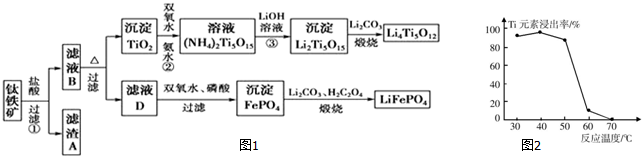
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
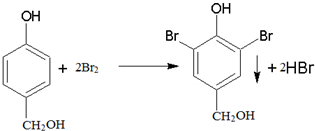 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
| �x�� | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| ���/mol•L-l | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |

 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
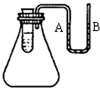
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com