
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ����ʯ��SiO2 | B�� | CO2��SiO2 | C�� | NaCl�� HCl | D�� | �c��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | H-F | B�� | H-O | C�� | H-N | D�� | H-C |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | BF3 | B�� | CCl4 | C�� | NH3 | D�� | H2O |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �x�ӻ������У�һ����x�ӿ�ͬ�r�c������x��֮�g���o����� | |
| B�� | �x�ӻ������е���x�Ӷ��ǽ����x�� | |
| C�� | ����ˮ���Ԍ�(d��o)늵Ļ�����һ�����x�ӻ����� | |
| D�� | ���ǽ���Ԫ�ظ��ǽ���Ԫ�ػ��϶��γ��x�ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 B�����ѳ������ЙC����(y��ng)���܄���������Ƃ������ѵķ���(y��ng)����Ҫ����b�����£�
B�����ѳ������ЙC����(y��ng)���܄���������Ƃ������ѵķ���(y��ng)����Ҫ����b�����£�| ���������|(zh��)�� | ���c/�� | �ܶȣ�g/cm3�� | ˮ���ܽ��� | |
| ������ | 74 | 117.2 | 0.819 | �� |
| ������ | 130 | 142.0 | 0.7704 | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
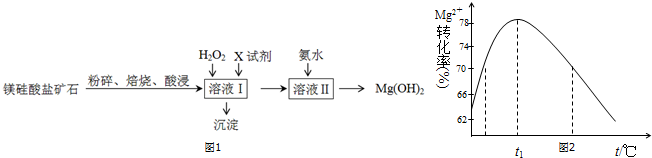
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| �_ʼ����r | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫ�r | 3.7 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
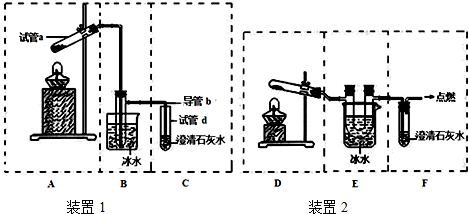
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
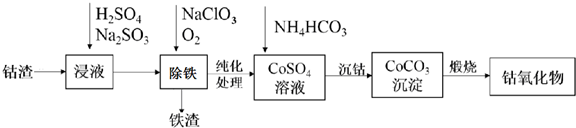
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com