
��Ŀ�� ��Դ�� �}�ͣ�����}
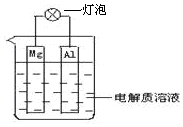 ��D��ʾ�b�ÿɘ�(g��u)��ԭ늳أ�ԇ�ش����І��}��
��D��ʾ�b�ÿɘ�(g��u)��ԭ늳أ�ԇ�ش����І��}���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �ڢܢ� | B�� | �ۢ� | C�� | �ڢܢ� | D�� | �ܢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

| ��ʼpH | pH=2.5 | pH=4.5 |
| NO3-��ȥ���� | �ӽ�100% | ��50% |
| 24С�r(sh��)pH | �ӽ����� | �ӽ����� |
| �F����K���|(zh��)�ΑB(t��i) |  |  |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)�}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ����I | ��̿���ڸߜؗl����߀ԭCuO����Cu2O��CO2 |
| ����II | ���£�N2H4��߀ԭ����Cu��OH��2 |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)�}
| T/K | 303 | 313 | 323 |
| n��NH3��/��l0-2 mol�� | 4.8 | 5.9 | 6.0 |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)�}
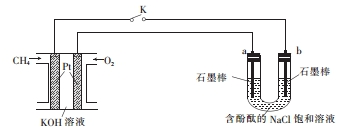
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com