
��Ŀ�� ��Դ�� �}�ͣ���x����
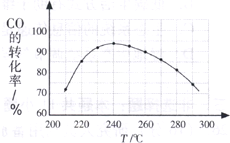 ��2010?�V��һģ�������ѣ�CH3OCH3����δ������������ͺ�Һ�������靍��Һ�wȼ��ʹ�ã�
��2010?�V��һģ�������ѣ�CH3OCH3����δ������������ͺ�Һ�������靍��Һ�wȼ��ʹ�ã�| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| 8.8��10-3V |
| m |
| 8.8��10-3V |
| m |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| ���Ҫ�� | �x� |
| ��ȥʳ�}������ɳ�ӣ�SiO2�� | |
| ��ȥʳ�}��I2 | |
| �C���عϷ��к��е��� | |
| �C��Na2CO3��Һ�ʉA�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com