
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���x����
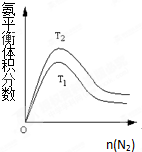 �ϳɰ����I(y��)������(j��ng)��������l(f��)չ������Ҫ�����x����ԭ��飺
�ϳɰ����I(y��)������(j��ng)��������l(f��)չ������Ҫ�����x����ԭ��飺| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
| ���M�e | �ض�/�� | ��ʼ��/mol | ƽ����/mol | �_��ƽ������r�g/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| �����̖ | ���� �|(zh��)��/g |
���٠�B(t��i) | c��H2SO4�� /mol?L-1 |
V��H2SO4��/mL | ��Һ�ض�/�� | ������ʧ�ĕr�g/s | |
| ����ǰ | ������ | ||||||
| 1 | 0.10 | �z | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | �z | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | �z | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | �z | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | �z | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | �z | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | �z | 1.1 | 50 | 30 | 44 | 40 |
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com