
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
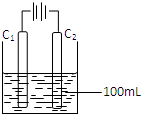 �\�û��W֪�R��Q���a(ch��n)�������е����P(gu��n)���}�����P(gu��n)ע��Ո�ش����І��}��
�\�û��W֪�R��Q���a(ch��n)�������е����P(gu��n)���}�����P(gu��n)ע��Ո�ش����І��}��| ���|(zh��) | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com