
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
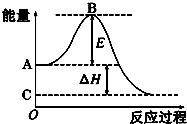 2CO��g��+O2��g��?2CO2��g������(y��ng)�^�̵�����׃����D��ʾ����֪1mol CO ��g��������1mol CO2 ��g���ġ�H=-283kJ/mol��Ո(q��ng)�ش����І��}��
2CO��g��+O2��g��?2CO2��g������(y��ng)�^�̵�����׃����D��ʾ����֪1mol CO ��g��������1mol CO2 ��g���ġ�H=-283kJ/mol��Ո(q��ng)�ش����І��}���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
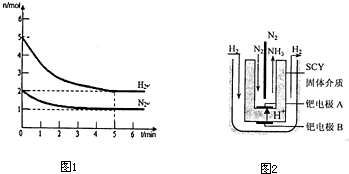
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
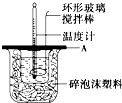 �քeȡ40mL��0.50mol/L�}���c40mL��0.55mol/L�������c��Һ�M(j��n)���кͷ���(y��ng)��ͨ�^�y(c��)������(y��ng)�^�������ų��ğ�����Ӌ(j��)���к͟ᣮՈ(q��ng)�ش����І��}��
�քeȡ40mL��0.50mol/L�}���c40mL��0.55mol/L�������c��Һ�M(j��n)���кͷ���(y��ng)��ͨ�^�y(c��)������(y��ng)�^�������ų��ğ�����Ӌ(j��)���к͟ᣮՈ(q��ng)�ش����І��}��| ��(sh��)�(y��n) ��̖(h��o) |
��ʼ�ض�t1/�� | �Kֹ�ض�t2/�� | |
| �}�� | �������c | �����Һ | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| c(Na+) | ||
c(C
|
| 20 |
| 9 |
| C1 |
| C2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
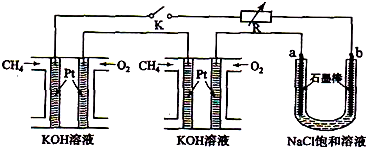
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
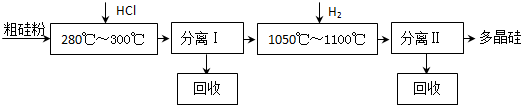
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
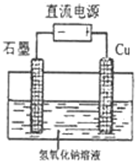
| ||
| ���� |
| Cu2O |
| ��̖(h��o) | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| �ض�/�� | |||||||
| �� | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| �� | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| �� | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com