
科目: 來源: 題型:單選題
查看答案和解析>>
科目: 來源: 題型:解答題
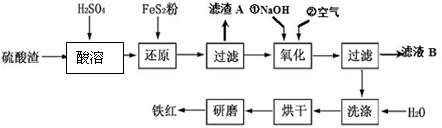
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 開始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 方法Ⅰ | 用硫和氮的氧化物之間的相互轉化聯(lián)合進行的脫硫和脫硝技術 |
| 方法Ⅱ | 用乙烯作為還原劑將氮的氧化物還原為N2的脫硝技術 |
| 方法Ⅲ | 用電化學原理將SO2轉化為重要的化工原料H2SO4的脫硫技術 |
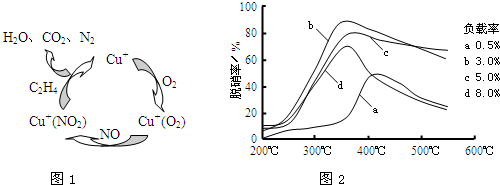
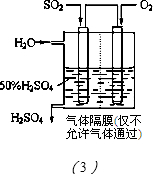
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:多選題
查看答案和解析>>
科目: 來源: 題型:單選題
查看答案和解析>>
科目: 來源: 題型:單選題
查看答案和解析>>
科目: 來源: 題型:解答題
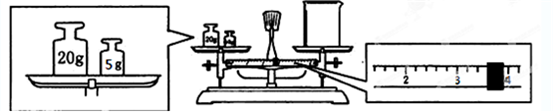
查看答案和解析>>
科目: 來源: 題型:單選題
 =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O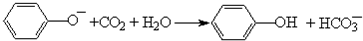
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com