
題目列表(包括答案和解析)


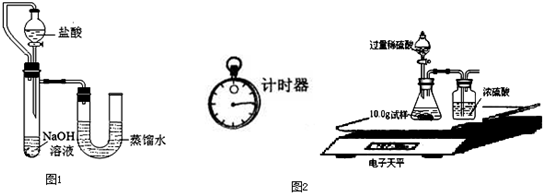
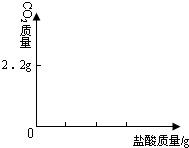
| 編號 | 鹽酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
| 編號 | 鹽酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
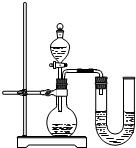
| 稱 量 項 目 | 稱 量 時 間 | 質量(g) |
| 試樣 | 10.00 | |
| 裝置+稀硫酸質量 | 241.20 | |
| 裝置+稀硫酸質量+試樣 | 反應開始后15秒 | 249.20 |
| 裝置+稀硫酸質量+試樣 | 反應開始后35秒 | 249.00 |
| 裝置+稀硫酸質量+試樣 | 反應開始后55秒 | 249.00 |
| 編號 | 鹽酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com