
題目列表(包括答案和解析)
 硝酸與金屬反應(yīng)時,濃度越稀還原產(chǎn)物價態(tài)越低.現(xiàn)用一定量的鋁粉與鎂粉組成的混合物與100ml硝酸鉀溶液與硫酸組成的混合溶液充分反應(yīng),反應(yīng)過程中無任何氣體放出,相反應(yīng)后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液體積與與產(chǎn)生的沉淀質(zhì)量的關(guān)系如圖所示.回答下列問題:
硝酸與金屬反應(yīng)時,濃度越稀還原產(chǎn)物價態(tài)越低.現(xiàn)用一定量的鋁粉與鎂粉組成的混合物與100ml硝酸鉀溶液與硫酸組成的混合溶液充分反應(yīng),反應(yīng)過程中無任何氣體放出,相反應(yīng)后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液體積與與產(chǎn)生的沉淀質(zhì)量的關(guān)系如圖所示.回答下列問題:
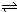 N2O4(g)達到平衡.
N2O4(g)達到平衡.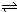 N2O4(g)的平衡常數(shù)K.
N2O4(g)的平衡常數(shù)K.湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com