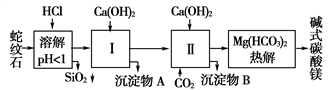
蛇紋石礦可以看做由MgO���、Fe2O3����、Al2O3����、SiO2組成�����。由蛇紋石制取堿式碳酸鎂的實(shí)驗(yàn)步驟如下:
(1)蛇紋石礦加鹽酸溶解后�����,溶液里除了含Mg2+外����,還含有的金屬離子是________���。
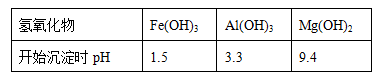
(2)進(jìn)行(Ⅰ)操作時(shí),控制溶液pH=7~8(有關(guān)氫氧化物沉淀的pH見下表)
Ca(OH)2不能過量�����,若Ca(OH)2過量可能會(huì)導(dǎo)致______溶解、________沉淀����。
(3)從沉淀混合物A中提取紅色氧化物作顏料�,先向沉淀物A中加入________(填入物質(zhì)的化學(xué)式)���,然后____________________(依次填寫實(shí)驗(yàn)操作名稱)����。
(4)物質(zhì)循環(huán)使用�����,能節(jié)約資源。上述實(shí)驗(yàn)中���,可以循環(huán)使用的物質(zhì)是____________(填寫物質(zhì)化學(xué)式)。
(5)現(xiàn)設(shè)計(jì)一個(gè)實(shí)驗(yàn)�����,確定產(chǎn)品aMgCO3·bMg(OH)2·cH2O中a�����、b�����、c的值�,請完善下列實(shí)驗(yàn)步驟(可用試劑:濃硫酸��、堿石灰):
①樣品稱量�,②高溫分解,③________________��,④____________�,⑤MgO稱量����。