
題目列表(包括答案和解析)
10.(2010·北京市目標檢測)已知Ca(OH)2的溶解度隨溫度的升高而降低。將40℃的飽和澄清石灰水冷卻至10℃,或保持40℃向其中加入少量CaO,兩種情況下均保持不變的是( )
A.溶液中Ca2+的數(shù)目
B.溶劑的質量
C.溶液中溶質的物質的量濃度
D.溶質的質量
解析:將40℃的飽和澄清石灰水冷卻至10℃時,此時溶液是不飽和溶液,溶液中溶質質量、溶劑質量均不變,所以溶液中Ca(OH)2的物質的量濃度不變。保持40℃向其中加入少量CaO,CaO與H2O反應導致溶劑質量減少,有部分Ca(OH)2晶體析出,但溶液仍是40℃時的飽和溶液,所以Ca(OH)2的物質的量濃度不變,綜合上述知選項C正確。
答案:C
9.(2010·石家莊質檢(一))下列各組中兩種氣體所含的原子數(shù)一定相等的是( )
A.質量相等、密度不等的N2和CO
B.溫度相同、體積相同的O2和N2
C.體積相等、密度相等的CO和C2H4
D.壓強相同、體積相同的N2和O2
解析:A項,氮氣和一氧化碳的摩爾質量相等,質量相等時物質的量相等,故原子數(shù)一定相等;B項,壓強不一定相等,則兩氣體的物質的量不一定相等;C項,體積和密度相等,則兩氣體的質量相等,由于摩爾質量相等,則兩者的物質的量相等,則原子數(shù)之比為1:3;D項,溫度不一定相同,則原子數(shù)不一定相等。
答案:A
8.(2010·武漢市武昌區(qū)調研)設NA為阿伏加德羅常數(shù),下列敘述中正確的是( )
①106 g Na2CO3晶體中的離子總數(shù)大于3 NA
②標準狀況下,16 g O3和O2混合氣體中含有的氧原子數(shù)為NA
③將0.1 mol NaCl全部溶于乙醇中制成膠體,其中含有的膠體粒子數(shù)目為0.1 NA
④1 mol N2和3 mol H2在一定條件下的密閉容器中充分反應,容器內的分子數(shù)大于2 NA
A.①② B.②④
C.①③ D.③④
解析:106 g碳酸鈉晶體中的離子總數(shù)為3 NA,故①錯誤;由于膠體粒子是多個微粒的集合體,故③中所含的膠體粒子數(shù)目小于0.1 NA,錯誤;④中由于1 mol N2和3 mol H2發(fā)生可逆反應,反應不能進行完全,故反應后氣體分子數(shù)要大于2 NA,④正確。
答案:B
7.(2010·襄樊市調研)用NA表示阿伏加德羅常數(shù)的值。下列敘述正確的是( )
A.標準狀況下的33.6 mL氯氣通入足量水中,轉移電子數(shù)為1.5×10-3 NA
B.標準狀況下,22.4 L四氯化碳中共價鍵數(shù)目為4 NA
C.1L濃度為1 mol·L-1的Na2CO3溶液中含有3 NA個離子
D.合成氨反應達到平衡時,每形成NA個N≡N鍵的同時,就有6 NA個N-H鍵形成
解析:反應Cl2+H2O===HCl+HClO為可逆反應,不可能進行完全,因此33.6 mL氯氣通入足量水中,轉移電子數(shù)小于1.5×10-3 NA,A錯;標準狀況下四氯化碳為液體,不能運用氣體摩爾體積計算其物質的量,B錯;Na2CO3溶液中由于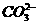 的水解反應:
的水解反應: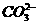 +H2O===HCO-3+OH-,離子數(shù)目增多,因此1 L濃度為1 mol/L的該溶液中離子數(shù)目大于3NA,C錯;根據(jù)N2+3H2===2NH3,反應達平衡時,每生成1 mol N2分子(形成1 mol N≡N鍵)的同時生成2 mol NH3分子(形成6 mol N-H鍵),D對。
+H2O===HCO-3+OH-,離子數(shù)目增多,因此1 L濃度為1 mol/L的該溶液中離子數(shù)目大于3NA,C錯;根據(jù)N2+3H2===2NH3,反應達平衡時,每生成1 mol N2分子(形成1 mol N≡N鍵)的同時生成2 mol NH3分子(形成6 mol N-H鍵),D對。
答案:D
6.(2010·江西省高三聯(lián)考)在200 mL某硫酸鹽溶液中,含有1.5 NA個硫酸根離子(NA表示阿伏加德羅常數(shù)的值),同時含有NA個金屬離子。則該硫酸鹽的物質的量濃度為( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
解析:由硫酸鹽溶液中含有1.5 NA個硫酸根離子,同時含有NA個金屬離子,可知金屬離子與硫酸根離子物質的量之比為2:3,故其化學式可表示為:M2(SO4)3,所以其物質的量濃度為0.5 mol/0.2 L=2.5 mol·L-1。
答案:B
5.(2010·江西省重點中學第二次聯(lián)考)在4℃時向100 mL水中溶解了22.4 L HCl氣體(標準狀況下測得)后形成的溶液。下列說法中正確的是( )
A.該溶液物質的量濃度為10 mol/L
B.所得溶液的體積為22.5 L
C.根據(jù)題干數(shù)據(jù),該溶液物質的量濃度無法求得
D.該溶液中溶質的質量分數(shù)因溶液的密度未知而無法求得
解析:該溶液的體積應該大于100 mL,溶液的質量為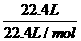 ×36.5 g/mol+100 mL×1 g/mL=136.5 g,由于沒有提供溶液的密度,無法計算出溶液的體積,因此該溶液的物質的量濃度無法計算,A錯、B錯、C對;溶質的質量分數(shù)為
×36.5 g/mol+100 mL×1 g/mL=136.5 g,由于沒有提供溶液的密度,無法計算出溶液的體積,因此該溶液的物質的量濃度無法計算,A錯、B錯、C對;溶質的質量分數(shù)為 ×100%=26.7%,D錯。
×100%=26.7%,D錯。
答案:C
4.(2010·江西省高三聯(lián)考)如圖所示,兩個連通容器用活塞分開,左右兩室(體積相同)各充入一定量NO和O2,且恰好使兩容器內氣體密度相同。打開活塞,使NO與O2充分反應。下列判斷正確的是(不考慮NO2轉化為N2O4)( )
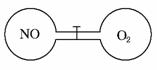
A.開始時左右兩室分子數(shù)相同
B.反應前后NO室壓強相同
C.最終容器內密度與原來相同
D.最終容器內無O2存在
解析:由左右兩室體積相同,兩容器內氣體密度相同可知,兩容器中氣體的質量一定相等,而NO和O2的摩爾質量不相等,故其物質的量不相等,開始時左右兩室分子數(shù)不相同,故A錯誤。由于反應后NO室的氣體物質的量要減小,故壓強要減小,B錯誤。由于NO與O2反應,O2過量,故最終容器內有O2存在,D錯誤。
答案:C
3.(2010·武漢市武昌區(qū)調研)設NA為阿伏加德羅常數(shù),下列說法正確的是( )
A.電解精煉銅過程中,電路中每通過NA個電子,陽極溶解銅32 g
B.1 L 2 mol/L的NH4Cl溶液中含NH+4數(shù)目為2 NA
C.5.6 g鐵粉與硝酸反應失去的電子數(shù)一定為0.3 NA
D.1 mol C20H42的分子中含有的共價鍵數(shù)目為61 NA
解析:電解精煉銅時,粗銅作陽極,由于粗銅中含有雜質Fe、Ni等,電路中每通過NA個電子,陽極溶解銅小于32 g,A錯;1 L
2 mol/L的NH4Cl溶液中NH+4會發(fā)生水解,故其數(shù)目小于2 NA,B錯;鐵粉與硝酸反應時,由于硝酸用量的不同可能生成Fe2+(少量硝酸)或Fe3+(過量硝酸),因此5.6 g鐵粉與硝酸反應時失去的電子數(shù)為0.2 NA~0.3 NA,C錯;1 mol C20H42中含有共價鍵數(shù)目為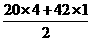 ×NA=61 NA,D對。
×NA=61 NA,D對。
答案:D
2.(2010·南昌市調研)設NA為阿伏加德羅常數(shù),下列說法正確的是( )
A.1 mol氧單質一定含有2 NA個氧原子
B.含4 mol Si-O鍵的石英晶體中含氧原子數(shù)為4 NA
C.6.8 g液態(tài) KHSO4中含有0.05 NA個陽離子
D.1 mol H3O+中含質子數(shù)為10 NA
解析:A選項,氧單質指代不明,可能是O2或O3;B選項,1 mol SiO2含有4 mol Si-O鍵,故含有4 mol Si-O鍵的石英晶體中含有2 mol O;D選項,1 mol H3O+含有的質子為11 mol。
答案:C
1.(2010·贛州市質檢)在化學學科中經常使用下列物理量,其中跟阿伏加德羅常數(shù)(NA)無關的組合是( )
①相對原子質量;②摩爾質量(g/mol);③原子半徑;④中和熱(kJ/mol);⑤物質的量;⑥化學反應速率[mol/(L·s)];⑦氣體摩爾體積(L/mol);⑧溶解度;⑨燃燒熱(kJ/mol);⑩溶質的質量分數(shù)
A.①③⑧⑩ B.②④⑤⑥⑦⑨
C.①②③④⑤ D.⑥⑦⑧⑨⑩
解析:根據(jù)物理量的單位,可以判斷其與阿伏加德羅常數(shù)是否有關,相對原子質量、溶質的質量分數(shù)為具體數(shù)值,原子半徑的單位為nm,溶解度的單位為g,這些物理量與阿伏加德羅常數(shù)均無關。
答案:A
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com