
題目列表(包括答案和解析)

 某化學(xué)興趣小組欲制取氨氣和氯化氫氣體并完成噴泉實驗(圖中夾持裝置均已略去).
某化學(xué)興趣小組欲制取氨氣和氯化氫氣體并完成噴泉實驗(圖中夾持裝置均已略去).
| ||
| ||
| 你的判斷 | NH2 | HCl |  |
| 能夠制的 | a中藥品: 濃氨水 濃氨水 b中藥品: 氫氧化鈉固體或氧化鈣 氫氧化鈉固體或氧化鈣 |
a中藥品: 濃鹽酸 濃鹽酸 b中藥品: 濃硫酸 濃硫酸 | |
| 不能制的 | 原因: 無 無 |
原因: 無 無 |
| 1 |
| 22.4 |
| 1 |
| 22.4 |
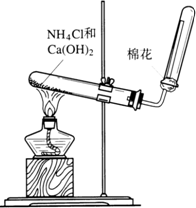 右圖是實驗室制取氨氣的裝置圖.請回答:
右圖是實驗室制取氨氣的裝置圖.請回答:
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com