
題目列表(包括答案和解析)

| 鋰 | X | Y | |
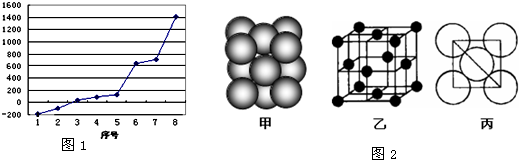
| 失去第一個(gè)電子 | 519 | 502 | 580 |
| 失去第二個(gè)電子 | 7 296 | 4 570 | 1 820 |
| 失去第三個(gè)電子 | 11 799 | 6 920 | 2 750 |
| 失去第四個(gè)電子 | 9 550 | 11 600 |
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||


| ||
| 8NAd3 |
| ||
| 8NAd3 |
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||


百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com