
�}Ŀ�б�(�����𰸺ͽ���)
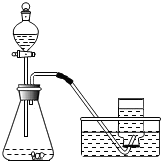 �n��С�M�о���Ӱ�H2O2 ����O2�������ʵ����ء����n�}��ͨ�^����Y�ϣ�����������²��룮
�n��С�M�о���Ӱ�H2O2 ����O2�������ʵ����ء����n�}��ͨ�^����Y�ϣ�����������²��룮| ��̖ | �� | �� | �� |
| ������ | 5%H2O250mL | 5%H2O2 50mL 50mL |
3%H2O250mL |
| ������w | 0.5gCuO | 0.5gMnO2 | 0.5gMnO2 |
| �ռ����w�eO2����r�g | 105s | 45s | 78s |
| ||
| ||
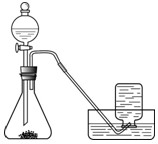
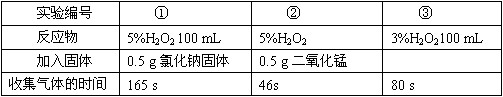

| ��̖ | �� | �� | �� |
| ������ | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2100 mL |
| ������w | 0.5 g�Ȼ��c���w | 0.5 g�������i | |
| �ռ����w�ĕr�g | 165 s | 46s | 80 s |
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com