
科目: 來源: 題型:解答題
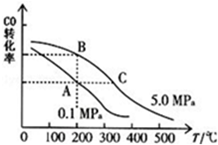
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
 發(fā)生在天津港“8•12”特大火災爆炸事故,再一次引發(fā)了人們對環(huán)境問題的關注.
發(fā)生在天津港“8•12”特大火災爆炸事故,再一次引發(fā)了人們對環(huán)境問題的關注.查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | H2(g)+12O2(g)═H2O(g)△H=-285.8kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目: 來源: 題型:解答題
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 總壓強p/100kPa | 4.00 | 4.20 | 4.50 | 5.20 | 6.00 | 6.00 |
查看答案和解析>>
科目: 來源: 題型:解答題
 請回答下列問題:
請回答下列問題:查看答案和解析>>
科目: 來源: 題型:填空題
| 物質(zhì) | C(s) | H2(g) | C2H4(g) | C2H6(g) | C3H8(g) | C12H26(l) |
| △H/ kJ•mol-1 | -393.5 | -285.8 | -1 411.0 | -1 559.8 | -2 219.9 | -8 571.4 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com