
żÆÄżŁș íÔŽŁș î}ĐÍŁș
 ÈçDÊÇij͏WÀûÓĂŚąÉäÆśÔOÓ”ÄșÒŚòŃbÖĂŁźŒŚčÜÖĐŚąÈë10mL
ÈçDÊÇij͏WÀûÓĂŚąÉäÆśÔOÓ”ÄșÒŚòŃbÖĂŁźŒŚčÜÖĐŚąÈë10mL Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
| C-O | C=O | CĄÔO | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | NĄÔN | |
| N2 | 154.8 | 418.4 | 941.7 |
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
| ۶È/Ąæ | 200 | 250 | 300 | 350 |
| Æœșⳣ”(shšŽ)K | 9.94 | 5.2 | 1 | 0.5 |
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
| »ŻWæI | C-C | C-H | H-H | C-O | CĄÔO | H-O |
| æIÄÜ/KJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ·ŽȘrég/min | 0 | 5 | 10 | 15 | 20 | 25 |
| ș/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁș íÔŽŁș î}ĐÍŁș
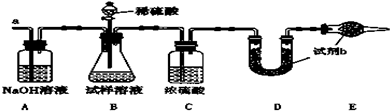
Č鿎Žđ°žșÍœâÎö>>
°Ù¶ÈÖÂĐĆ - ŸÁÔÁбí - Ôî}Áбí
șț±±ÊĄ»„Â(lišąn)ŸW(wšŁng)ß`·šșÍČ»ÁŒĐĆÏąĆeóÆœĆ_ | ŸW(wšŁng)ÉÏÓĐșŠĐĆÏąĆeóŁ ^(qš±) | ëĐĆÔpò_ĆeóŁ ^(qš±) | ÉævÊ·ÌoÖśÁxÓĐșŠĐĆÏąĆeóŁ ^(qš±) | ÉæÆóÇÖà(qušąn)ĆeóŁ ^(qš±)
ß`·šșÍČ»ÁŒĐĆÏąĆeóëÔŁș027-86699610 Ćeóà]ÏäŁș58377363@163.com