
科目: 來(lái)源: 題型:填空題
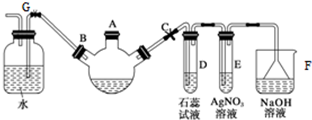
 .
.查看答案和解析>>
科目: 來(lái)源: 題型:填空題
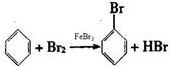
查看答案和解析>>
科目: 來(lái)源: 題型:解答題

查看答案和解析>>
科目: 來(lái)源: 題型:解答題
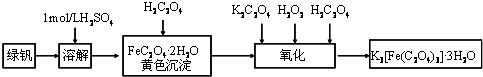
查看答案和解析>>
科目: 來(lái)源: 題型:選擇題
| A. | 氯化鋁溶液和硫化鈉溶液反應(yīng)制備Al2S3 | |
| B. | 用鎂粉和空氣反應(yīng)制備Mg3N2 | |
| C. | 用鋁粉和MnO2制得錳 | |
| D. | 電解熔融氯化鋁的方法制得單質(zhì)鋁 |
查看答案和解析>>
科目: 來(lái)源: 題型:填空題
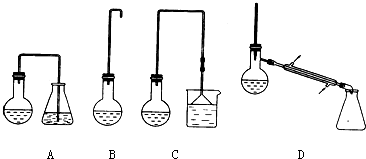
| 熔點(diǎn)/℃ | 沸點(diǎn)/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
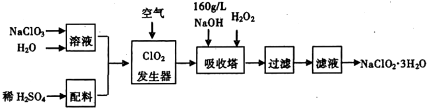
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
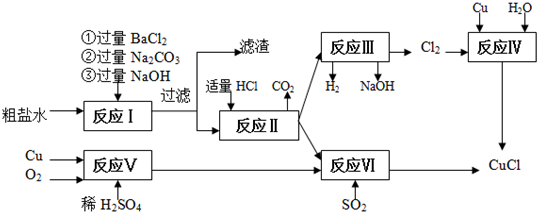
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
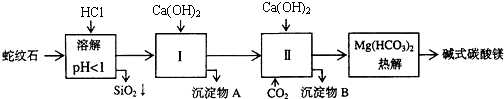
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 開(kāi)始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目: 來(lái)源: 題型:填空題
 已知:CH3CH2OH+NaBr+H2SO4(濃) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(濃) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com